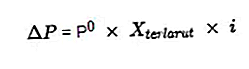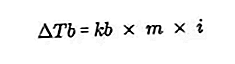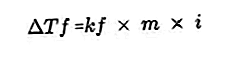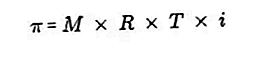Spróbuj zwrócić uwagę na to, co wokół nas jest związane z chemią? Najłatwiejsze jest powietrze, którym oddychamy, które zawiera mieszankę tlenu, azotu i innych gazów. Przyprawy do żywności, barwniki spożywcze i środki konserwujące to także inne przykłady otaczających nas chemikaliów. Chemia to dziedzina nauk przyrodniczych, której będziesz się uczyć w szkole, która bada różne materiały, jednym z przykładów jest struktura materii, właściwości materii, forma materialna, zmiany w materii, klasyfikacja materii, układ materii i energia, która im towarzyszy zmiany. Nie tylko matematyka i fizyka, chemia ma również różne rodzaje wzorów. Istnieje wiele wzorów chemicznych, z których się nauczysz, od właściwości koligatywnych po reakcje redoks.
Przy tej okazji poznamy różne wzory chemiczne, a także przykłady ich problemów, które pomogą Ci zrozumieć koncepcje wzorów chemicznych.
Wzory chemiczne i przykładowe problemy
Obecność formuł w chemii ma pomóc naukowcom w znalezieniu różnego rodzaju wyników eksperymentalnych do przeprowadzenia. Aby dobrze opanować tę naukę, musisz znać pewne wzory chemiczne, z którymi często się spotykasz podczas studiowania chemii.
Wzór na koligatywne właściwości rozwiązań
Koligatywny charakter roztworu jest charakterem roztworu, który nie zależy od rodzaju rozpuszczalnej substancji, ale zależy tylko od stężenia cząstek roztworu. Następnie na właściwości koligatywne roztworu składają się dwa rodzaje właściwości, a mianowicie koligatywny charakter roztworu elektrolitu i koligatywny charakter roztworu nieelektrolitu.
- Właściwości koligatywne roztworów nieelektrolitów
Chociaż charakter koligatywny obejmuje roztwór, charakter koligatywny nie zależy od interakcji cząsteczek substancji rozpuszczonej i substancji rozpuszczonej, ale od ilości substancji rozpuszczonej w roztworze. Właściwości koligatywne polegają na spadku prężności pary, podwyższeniu temperatury wrzenia, obniżeniu temperatury krzepnięcia i ciśnieniu osmotycznym. Każdy z nich wymaga wzoru chemicznego, aby uzyskać wynik.
- Równanie spadku ciśnienia pary

Źródło: formula.co.id
- Równanie wzrostu temperatury wrzenia
Temperatura wrzenia cieczy to ustalona temperatura, w której wrze. W tej temperaturze ciśnienie pary cieczy ma równanie na ciśnienie powietrza wokół niej i jest spowodowane parowaniem wszystkich części cieczy. Temperaturę wrzenia cieczy można zmierzyć pod ciśnieniem 1 atmosfery.
Różnica między temperaturą wrzenia roztworu a temperaturą wrzenia czystego rozpuszczalnika nazywana jest wzrostem temperatury wrzenia, równanie wzrostu temperatury wrzenia to:

Źródło: formula.co.id
- Równanie spadku punktu zamarzania
Substancja rozpuszczona obecna w roztworze spowoduje, że temperatura zamarzania roztworu będzie mniejsza niż temperatura zamarzania rozpuszczalnika. Równanie redukcji punktu zamarzania:

Źródło: formula.co.id
- Ciśnienie osmotyczne
Ciśnienie osmotyczne to siła potrzebna do zrównoważenia ciśnienia rozpuszczalnika z półprzepuszczalnej membrany przez roztwór.
Membrana półprzepuszczalna to membrana, przez którą mogą przechodzić cząsteczki rozpuszczalnika, ale substancje rozpuszczone nie mogą przez nią przechodzić. Według Van't Hoffa, przy ciśnieniu osmotycznym roztwór formułuje się w następujący sposób:

Źródło: formula.co.id
- Właściwości koligatywne roztworów elektrolitów
W stężeniu właściwości koligatywnych tego samego roztworu elektrolitu ma on większą wartość, gdy porównamy go z właściwościami koligatywnymi roztworu nieelektrolitu. Ze względu na dużą liczbę cząstek rozpuszczonych powstałych w wyniku reakcji jonizacji roztworu elektrolitu, który został sformułowany w oparciu o współczynnik Van't Hoffa.
Obliczenie właściwości koligatywnych roztworu elektrolitu będzie zawsze mnożone przez współczynnik Van't Hoffa w następujący sposób:

Źródło: formula.co.id
Niektóre wzory na właściwości koligatywne innych roztworów elektrolitów to:
- Spadek ciśnienia pary
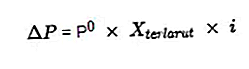
Źródło: formula.co.id
- Wzrost temperatury wrzenia
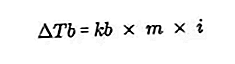
Źródło: formula.co.id
- Spadek punktu zamarzania
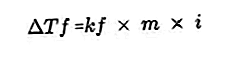
Źródło: formula.co.id
- Ciśnienie osmotyczne
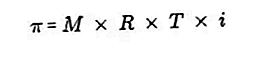
Źródło: formula.co.id
Wzory na molarność, molalność i ułamki molowe
Molarność (M)
Molarność to liczba moli substancji rozpuszczonej w 1 litrze roztworu.

Źródło: formula.co.id
M = molarność
Mr = masa molowa substancji rozpuszczonej (g / mol)
V = objętość roztworu
Molalność (m)
Molalność to liczba moli substancji rozpuszczonej w 1 kg rozpuszczalnika. Wzór chemiczny jest następujący.

Źródło: formula.co.id
m = molalność (mol / kg)
Mr = masa molowa substancji rozpuszczonej (g / mol)
masa = masa substancji rozpuszczonej (g)
P = masa rozpuszczalnika (g)
Frakcja molowa
Ułamek molowy to jednostka stężenia, w której wszystkie składniki roztworu są obliczane na podstawie moli.

Źródło: formula.co.id
xi = liczba moli
i, j, xj = ułamek molowy
Przykłady problemów z wzorami chemicznymi
1. Jeżeli ciśnienie osmotyczne 500 ml roztworu fruktozy C6H12O6 z 32 ° C wynosi 2 atm, to masa rozpuszczonej fruktozy wynosi?
Rozwiązanie:

2. W ułamku molowym roztworu mocznika w wodzie 0,2. Nasycona prężność pary czystej wody o temperaturze 20 ° C wynosi 17,5 mmHg. Następnie przy nasyconej prężności pary roztworu w następującej temperaturze wynosi?
Xmocznik + Xwoda = 1
0,2 + Xwoda = 1
Xwoda = 0,8
P.rozwiązanie = Xwoda x P woda
P.rozwiązanie = 0,8 x 17,5 mmHg
P.rozwiązanie = 14 mmHg
Oto kilka wzorów chemicznych, których możesz się nauczyć, aby ułatwić sobie odpowiadanie na różnego rodzaju pytania chemiczne. Jeśli uważasz, że te formuły to za mało, możesz wypróbować produkt PROBLEM, ważone, kompletne rozwiązanie online do ćwiczenia pytań w klasie Smart, takich jak trygonometria, limit, logarytm i wiele innych. Począwszy od poziomu podstawowego, przez gimnazjum po liceum z różnymi przedmiotami, takimi jak matematyka, fizyka, chemia i inne. Tutaj możesz nauczyć się różnego rodzaju formuł wraz z przykładowymi problemami.
No dalej, na co czekasz! Wypróbujmy teraz ćwiczenia PROBLEM w Smart Class.